Richard Malik DVSc PhD FACVS Centrum FASM pre Veterinárne vzdelávanie, Univerzita v Sydney
Pôvodný článok: Treatment of FIP in cats with subcutaneous remdesivir followed by oral GS-441524 tablets
Poznámka prekladateľa: Článok obsahuje informácie o reálnom obsahu GS-441524 v tabletách. Tento obsah ale nemusí zodpovedať “ekvivalentnému” množstvu GS-441524 v tabletách od iných výrobcov, kde je reálny obsah GS-441524 vždy o niečo vyšší kvôli známej zníženej biologickej dostupnosti perorálne používaného liečiva. Preto nie je možné jednoducho a jednoznačne porovnávať doporučene dávkovanie GS-441524 od firmy BOVA v Austrálii a u nás.
Úvod
Infekčná peritonitída mačiek (FIP) je infekčné ochorenie, najmä mladých mačiek. Dochádza k nemu, keď mačací enterický koronavírus množiaci sa v črevách prechádza kritickou mutáciou, ktorá zmení jeho tkanivový tropizmus z enterocytov na makrofágy. Vírus FIP potom cirkuluje po tele v makrofágoch – jedná sa o ultimátny mechanizmus trójskeho koňa. To vedie k diseminovanej infekcii a rozvoju fibrinoidnej nekrotizujúcej vaskulitídy a serozitídy v dôsledku ukladania imunitných komplexov pozostávajúcich z mačacích protilátok a FIP vírusových antigénov.
Vo všeobecnosti existujú dve formy FIP – efuzívna („vlhká“) FIP a neefuzívna („suchá“) FIP. Vlastný chorobný proces sa môže vyskytnúť v brušnej dutine, hrudnej dutine, osrdcovníku, očiach alebo centrálnom nervovom systéme. Kombinácie suchej a vlhkej FIP s postihnutím rôznych tkanív nie sú ničím nezvyčajným.
Až donedávna bola diagnóza infekčnej peritonitídy mačiek (FIP) pre mačacieho pacienta rozudkom smrti. V posledných rokoch však táto predstava bola postavená na hlavu ako výsledok priekopníckej práce profesora Nielsa C. Pedersena a kolegov z UC Davis.
Za posledných 12 mesiacov mnohí veterinári v Austrálii tiež úspešne zvládli mnoho prípadov FIP pomocou remdesiviru a GS-441524.
Omega-interferón (Virbagen) a polyprenyl imunostimulant (PPI) boli prvé lieky používané na liečbu FIP a obe mali u niektorých pacientov isté účinky. Omega interferón bol užitočný v prípadoch efuzívnej („vlhkej“) FIP, často kombinovanej s nízkou dávkou prednizolónu podľa Ishidovho protokolu, zatiaľ čo PPI, ktorého priekopníkom bol Al Legendre, bol užitočnejší v prípadoch neefuzívnej FIP. V niektorých prípadoch boli oba lieky použité súčasne. Problém bol v tom, že obe formy terapie boli často drahé, najmä keď sa používali oba lieky, takže aj keď sa pacienti zlepšili a mohli mať prechodné klinické remisie počas liečby, trvalé klinické vyliečenia boli zriedkavé. V dôsledku toho väčšina veterinárov stále považovala diagnózu FIP za predohru eutanázie.
To všetko sa zmenilo pred niekoľkými rokmi vďaka vyvrcholeniu celoživotneho výskumu FIP Dr. Nielsa Pedersena. Niels je úžasný veterinár, Severoameričan s dánskym pôvodom. Vyrastal na slepačej farme a pôvodne chcel byť klinickým lekárom pre veľké zvieratá, ale s veľkou predvídavosťou sa rozhodol pre vedeckú dráhu. Krátko po promócii odcestoval do Canberry na John Curtin School of Medical Research na ANU, kde koncom 60-tych rokov získal doktorát z imunológie o odmietaní obličkového transplantátu u profesora Bede Morrisa, pričom použil ovce ako experimentálny model na štúdium kinetiky lymfocytov.
Keď sa Niels vrátil na UC Davis, zameral sa na štúdium infekcií a imunity. Aj keď prispel k veľkému množstvu tém z internej medicíny a genomiky psov a mačiek, FIP sa stala jeho obľúbenou chorobou pre svoju obyčajnosť a súčasnú zložitosť. Jeho štúdium siaha od 80. rokov 20. storočia, keď sa špecializoval na diagnostiku, virológiu a patogenézu, až po súčasnosť, s čoraz väčším zameraním na terapiu.
Niels v spolupráci s kolegami z Kansas State University ukázal, že účelovo navrhnutý inhibítor proteázy GC-376 by mohol zabrániť a vyliečiť experimentálne indukovanú FIP u laboratórnych mačiek.1,2 Klinické štúdie v teréne s mačkami s prirodzene sa vyskytujúcou chorobou boli sklamaním, najmä keď mačky mali okulárnu formu FIP alebo ochorenie CNS. Nevzdal sa, a tak prešiel na iný liek – GS-4415243,4 – nukleozidový analóg vyvinutý severoamerickou farmaceutickou spoločnosťou Gilead. Ukázalo sa, že táto molekula je oveľa účinnejšia ako GC-376 na liečbu FIP, a to ako pri experimentálnych infekciách, tak aj v spontánnych prípadoch FIP. Počnúc farmakokinetikou a štúdiami s eskaláciou dávky s použitím širokého spektra klinických prípadov, Niels a kolegovia zistili, že potrebná dávka závisí od toho, či mal pacient suchú alebo vlhkú FIP, a či došlo k postihnutiu očí alebo centrálneho nervového systému (CNS).5
Prekvapivo, Gilead, výrobca, ktorý vyvinul GS441524, doteraz neprejavil záujem o vývoj tejto molekuly pre liečbu mačiek. Aby sa vyplnila prázdno pre účinnú terapiu FIP na celom svete, rôzne laboratóriá v Číne a východnej Európe začali vyrábať GS-441524 a predávať ho na čiernom trhu.
Široká dostupnosť GS-441524, často vysokej kvality a spočiatku veľmi vysokej ceny, poskytla oddaným majiteľom spôsob, ako zachrániť ich mačky s FIP. Štúdie klinickej patologičky Samanthy Evansovej z Ohio State University naznačili mieru vyliečenia približne 80 % v teréne. Obstarávanie lieku bolo donedávna komplikované a plné problémov, ktoré sa na určitej úrovni obchádzali pomocou rôznych „FIP Warriors“ skupín na Facebooku. Nanešťastie pre austrálskych milovníkov mačiek, APVMA a Vet Boards nakoniec pochopili, čo sa deje a Border Force značne sťažila získavanie GS-441524 a jeho bezpečný dovoz pre veterinárne použitie. Varovania regulačných orgánov a veterinárnych výborov pred trestným stíhaním boli namierené proti veterinárom, ktorí umožňovali liečbu mačiek s FIP pomocou liekov z čierneho trhu.
Je iróniou, že nové riešenie tohto problému priniesla pandémia COVID 19. Gilead vyvinul remdesivir (GS-5734) ako liek na liečbu hepatitídy C, Eboly a ľudského koronavírusového ochorenia. Remdesivir je proliečivo GS-441524, ktoré obsahuje dodatočný chemický bočný reťazec (vrátane fosfátovej skupiny), ktorý má zlepšiť intracelulárnu penetráciu (obrázok 1B). Remdesivir (ako produkt Veklury) získal dočasnú registráciu (na dva roky) od TGA v júli 2020 na liečbu infekcií SARS-CoV-2 u ľudských pacientov s COVID-19. Tento proces registrácie by za normálnych okolností trval niekoľko rokov, ale závažnosť pandémie urýchlila tento proces s prihladnutím na predbežné dáta z klinických testov. Keďže sa remdesivir stal licencovaným ľudským liekom a Gilead licencoval výrobu po celom svete, znamenalo to viac možností prístupu ku kvalitnej surovine. Tým sa obišli problémy s užívaním lieku zakúpeného na čiernom trhu, ako aj problémy neznámej čistoty a konzistencie produktu v priebehu času.
V roku 2020 spoločnosť na výrobu veterinárnych zmesí BOVA Australia zabezpečila spoľahlivé dodávky remdesiviru vo vhodnom formáte na IV a subkutánnu aplikáciu. Štúdie v Austrálii určili, že doba použiteľnosti po rekonštitúcii presahuje 12 dní a potvrdili účinnosť in vitro proti koronavírusom v tkanivových kultúrach. Analytická čistota liečiva sa pravidelne kontroluje pomocou HPLC. Za posledný rok veterinári v každom štáte Austrálie používali remdesivir na liečbu mačiek s FIP. Vyskytlo sa množstvo efuzívnych a neefuzívnych prípadov, vrátane niektorých mačiek s postihnutím oka (uveitída) a iných s multifokálnym ochorením CNS. Na základe liečby približne 500 mačiek liečených medzi októbrom 2020 a novembrom 2021 sa remdesivir ukazuje ako vysoko účinný pri zvládaní infekcií FIP. Umožnuje o niečo jednoduchšiu subkutánnu aplikáciu a zdá sa, že injekcia je o niečo menej bolestivá v porovnaní s GS-441524 a nespôsobuje lokálne reakcie v mieste vpichu, ktoré sa pozorujú pri injekčnom podaní GS-441524. Pôvodne sa remdesivir používal výhradne v Austrálii, hoci posledné 2 mesiace je dostupný aj v Británii od BOVA UK.
Molekulová hmotnosť remdesiviru je 603 g/mol, zatiaľ čo molekulová hmotnosť GS-441524 je 291 g/mol. To by mohlo naznačovať, že liečba mačiek remdesivirom vyžaduje približne dvojnásobné dávkovanie v porovnaní s GS-441524, aj keď to nezohľadňuje možné zlepšenie intracelulárnej penetrácie remdesiviru do určitých tkanív v porovnaní s GS-441524. Navrhovaná dávka remdesiviru u ľudských pacientov s COVID19 je 200 mg intravenózne (IV), po ktorej nasleduje 100 mg IV denne. Pre 70 kg ľudského pacienta to predstavuje dennú dávku 1,3 mg/kg, takže pri použití alometrického škálovania bola dávka 5-10 mg/kg denne pre mačku považovaná za správnu. Naša skúsenosť z prvých 500 prípadov však bola taká, že veľa mačiek nakoniec pre trvalé vyliečenie potrebovalo vyššiu dávku remdesiviru, a preto sme upravili naše odporúčané dávkovanie smerom nahor (pozri nižsie). Remdesivir poskytuje BOVA ako sterilný roztok s koncentráciou 10 mg/ml pripravený na použitie v 10 ml injekčnej vialke.

V súčasnosti sú Austrália a Spojené kráľovstvo jedinými krajinami, kde je remdesivir ľahko dostupný na predpis pre veterinárne použitie. Veterinári v Indii, na Novom Zélande, v Južnej Afrike a v niektorých častiach Európy však tiež začali pre prístup k lieku využívat dodávateľov humánnych liečiv.
Diagnostika
Úplná diferenciálna diagnostika FIP presahuje rámec tohto článku, ale čitateľom dôrazne odporúčame prečítať si vynikajúci článok od Séverine Tasker v Journal of Feline Medicine & Surgery. 6
Hoci sa FIP môže vyskytnúť u mačiek v akomkoľvek veku, väčšina prípadov sa vyskytuje u mačiatok a mačiek mladších ako 3 roky. Pretrvávajúca a často vysoká horúčka, ktorá nereaguje na antibiotickú liečbu (a často ani NSAID), je bežným nálezom, rovnako ako zvýšená hladina celkového proteínu v plazme v dôsledku zvýšených koncentrácií globulínu (difúzna gamapatia pri elektroforéze séra). Pri efuzívnej alebo „vlhkej“ FIP môže pomer albumínu ku globulínu klesnúť na < 0,45. Reaktanty akútnej fázy, ako je sérový amyloid A a α1-kyslý glykoproteín, majú tendenciu byť výrazne zvýšené. Mnoho mačiek s FIP vykazuje tiež sekundárnu imunitne sprostredkovanú hemolytickú anémiu, zvýšené aktivity AST a ALT a ikterus.
Pre včasnú diagnózu je rozhodujúce diagnostické zobrazovanie, čo bolo značne uľahčené zavedením digitálnej rádiológie a rozšírenou dostupnosťou diagnostického ultrazvuku v praxi malých zvierat. Pleurálny výpotok je ľahko rozpoznateľný z röntgenových snímok hrudníka, zatiaľ čo brušný výpotok je najlepšie detekovaný pomocou ultrazvuku (obrázok 3), najmä ak sú k dispozícii vysokofrekvenčné sondy. Za zmienku stojí, že v niektorých prípadoch môžu byť kapsy s tekutinou ohniskové a lokalizované. Často je okolo obličky pod obličkovým puzdrom nejaká tekutina, mačiatka môžu mať edém skrota, zatiaľ čo v ojedinelých prípadoch je výpotok obmedzený na perikardiálny vak. Ale kľúčové je – hľadať (i) výpotok v akejkoľvek telesnej dutine, (ii) granulómy v obličkách, pečeni alebo pľúcach, (iii) zväčšené vnútrobrušné a mezenterické lymfatické uzliny (obrázok 5) alebo výrazné zhrubnutie iliocekokolickej oblasti („fokálna FIP“) (obrázok 5). Röntgenové snímky hrudníka po drenáži pleurálneho výpotku môžu ukázať zmeny zodpovedajúce vírusovej pneumónii.

Ak uvidíte výpotok – urobte punkciu – pretože tekutina je najlepšou diagnostickou vzorkou.
Charakteristická je tekutina s vysokým obsahom bielkovín, často žltej až slamovej farby (obrázok 3B). Ak v orgáne vidíte granulóm alebo ak sú zreteľne zväčšené lymfatické uzliny – urobte FNA (aspiračná biopsia tenkou ihlou), urobte náter, použite farbenie s RapidDiff a hľadajte neutrofily a makrofágy (pyogranulomatózny zápal) bez viditeľných infekčných agens (obrázok 4) . Dve choroby, ktoré sa najčastejšie zamieňajú s FIP u dospelých mačiek, sú lymfóm a niektoré typy lymfocytickej cholangitídy (spojené s ascitom s vysokým obsahom bielkovín).

Efuzívne ochorenie je samozrejme diagnostikovateľné oveľa ľahšie, pretože ascitická, perikardiálna alebo pleurálna tekutina poskytuje vhodnú vzorku, ktorá môže byť vyšetrená cytologicky, analýzou tekutiny a podrobená imunofluorescencii (IFA) na FIP antigén alebo PCR s reverznou transkriptázou na detekciu FIP nukleovej kyseliny. IFA sa vykonáva na VPDS, B14, University of Sydney (prostredníctvom Vetnostics, QML, ASAP, VetPath, Gribbles alebo IDEXX). Väčšinou je však najlacnejšie odoslať vzorku priamo do univerzitného laboratória.
Suchá FIP je problematickejšia, pretože zvyčajne vyžaduje aspiračnú biopsiu tenkou ihlou pyogranulomatóznych lézií v pečeni, obličkách alebo brušných lymfatických uzlinách. Občas môžu prípady vlhkej FIP paradoxne vykazovať vzorky tekutiny, ktoré sú negatívne pri testovaní IFA a/alebo PCR, no pacient stále pravdepodobne má FIP, čo sa prejavuje priaznivou odpoveďou na liečbu remdesivirom alebo GS-441524.
Liečba
Od októbra 2020 liečime mačky s FIP pomocou remdesiviru (IV a SCI) a odnedávna pomocou GS-441524 (orálne), takže naše protokoly sa skúsenosťami neustále vyvíjajú. Doteraz bolo liečených asi 500 mačiek. Snažíme sa vyhnúť tomu, aby sme boli v našich odporúčaniach príliš normatívni, pretože máme podozrenie, že neexistuje jednotný protokol, ktorý by vyhovoval všetkým pacientom, a každý prípad predstavuje jedinečné okolnosti, vrátane veľkosti pacienta, či je mačka stále „šťastná“ a je primerane, alebo je deprimovaná a dehydrovaná. Dôležitým faktorom je emocionálna a finančná angažovanosť majiteľa. Kľúčovou vlastnosťou, ktorú treba spomenúť, je, že oba lieky sú veľmi bezpečné, dokonca aj u chorých mačiek a mačiatok.
Všimnite si, že nasledujúce odporúčané dávky sú vyššie ako tie, ktoré boli pôvodne odporúčané pred rokom. Aj keď u mnohých pacientov fungovali nižšie dávky, zistili sme, že ide často o nesprávnu ekonomickú úvahu, pretože recidíva ochorenia na konci liečby a rozvoj vírusovej rezistencie počas liečby zrejme súvisia s nedostatočným počiatočným dávkovaním. Takže sme sa od začiatku naučili byť agresívnejší, čo je z dlhodobého hľadiska lacnejšie (tj nevyžaduje sa 2. terapia)
Naša najväčšia skúsenosť je spojená s remdesivirom. Tento liek je drahý a majiteľ sa musí zaviazať k nákladnému liečebnému procesu, ktorý trvá 3 mesiace. Pre väčšinu klientov to predstavuje emocionálnu a finančnú záťaž. Môj názor je, že v mnohých prípadoch je lepšie vynaložiť peniaze na antivírusovú terapiu ako takú, než na rozsiahlu diagnostiku a monitorovanie.

Jedným z prístupov u novodiagnostikovaných mačiek so závažným ochorením je hospitalizácia mačiek počas prvých 3-4 dní liečby. Pacienti začínajú liečbu remdesivirom, keď dostávajú IV tekutinovú terapiu (typicky 2-4 ml/kg/h; prvý deň Hartmannov roztok alebo Plasmalyte a následne 0,45 % NaCl a 2,5 % dextrózu s obsahom 20 mmol KCl/l). V 1. deň hospitalizácie sa remdesivir podáva vo vysokej dávke intravenózne (10–15 mg/kg zriedených na 10 ml fyziologickým roztokom a podáva sa POMALY počas 20–30 minút alebo dlhšie, manuálne alebo pomocou infúznej pumpy; u ľudských pacientov aplikácia trvá 2 hodiny), aby sa dosiahla zvýšená štartovacia dávka distribučného objemu liečiva. Tým sa dosiahne rýchla antivírusová účinnosť. V prípadoch s ochorením CNS odporúčame dennú IV dávku 20 mg/kg. Mnohé mačky sa môžu niekoľko hodín po IV infúzii remdesiviru javiť ako trochu deprimované. U ľudských pacientov môže remdesivir spôsobiť reakcie súvisiace s infúziou, vrátane nízkeho krvného tlaku, nevoľnosti, zvracania, potenia alebo triašky, ale u našich mačacích pacientov sme tieto javy nepozorovali.
Výhodou zahájenia liečby intravenózne je, že dehydratácia, ak je prítomná, sa upraví a máte IV prístup v prípade, že potrebujete podať iné lieky (napr. antikonvulzíva, kortikosteroidy). Dôležité je, že akonáhle je zavedený IV katéter, denné injekcie remdesiviru nespôsobujú žiadnu bolesť ani nepohodlie. Ak však mačka žerie a je diagnostikovaná v počiatočnom štádiu priebehu ochorenia, potom IV terapia nie je potrebná a rovnaké dávky možno podávať subkutánne, čím sa ušetrí veľa peňazí.
Mačky s FIP liečené remdesivirom sa typicky výrazne zlepšujú počas prvých 2-3 dní. Zistili sme však, že prípady efúzie a najmä tie, ktoré sa pred liečbou prejavili pleurálnym výpotkom, by sa mali dôkladne sledovať, pretože kombinácia antivírusového účinku remdesiviru a väčšej než udržiavacej dávky kryštaloidov môže viesť k prechodnému zhoršeniu pleurálneho výpotku. To vyžaduje drenáž dvakrát denne pomocou motýľovej ihly 19G (1,1mm – krémová farba) a 3-cestného uzatváracieho kohútika (ideálne pomocou ultrazvukového vedenia na nájdenie najlepšieho miesta pre zavedenie ihly). Tieto „sekundárne“ pleurálne výpotky môžu byť smrteľné, ak sa nezistia včas a zdá sa, že sa vyskytujú približne v 1 z 10 prípadov efuzívnych FIP liečených remdesivirom.
Ďalším problémom, ktorý sa v tejto dobe občas vyskytuje, je rozvoj neurologických príznakov, vrátane záchvatov. Náš názor je, že nejde o účinok lieku ako taký, ale skôr o demaskovanie subklinickej CNS FIP. Takéto mačky potrebujú starostlivé pozorovanie, zatiaľ čo vývoj záchvatov vyžaduje použitie antikonvulzívnych liekov, ako je midazolam (0,3 mg/kg IV), alfaxan alebo propofol (podávaný IV, aby bol účinný), po ktorom nasleduje levetiracetam (Keppra) (10–20 mg /kg, PO každých 8 hodín). Fenobarbitón je spoľahlivé antikonvulzívum, má však tendenciu zvyšovať metabolizmus mnohých liekov, a kým lepšie nepochopíme farmakokinetiku a metabolizmus remdesiviru a GS-441524, je pravdepodobne bezpečnejšie používať levetiracetam. Niektorí lekári tiež podávajú dexametazón alebo prednizolón ako jednorazovú liečbu na zmiernenie zápalu CNS.
Hoci obhajujeme úvodnú IV terapiu pre najťažšie prípady FIP, mačky a mačiatka, ktoré sú stále „šťastné“ a jedia, na začiatku nevyžadujú IV terapiu a môžu namiesto toho začať subkutánnymi injekciami v dávke 10-12 mg/kg/deň ( 20 mg/kg pri ochorení CNS). To je, samozrejme, oveľa lacnejšie, pretože mačky alebo mačiatka nemusia byť umiestnené na infúznej pumpe a hospitalizové v nemocnici, v stresujúcom prostredí. U klientov, ktorí majú finančné limity, môže byť toto vhodnejší spôsob zahájenia terapie. Niektorí šikovní kolegovia, ako napríklad Jim Euclid, vyvinuli hybridný prístup, kde mačiatka dostávajú subkutánne tekutiny denne ako bolus s injektovaným remdesivirom.
Následne boli mačkám podávané priebežné subkutánne injekcie remdesiviru. Pôvodne to trvalo 84 dní a takéto prípady predstavovali väčšinu prípadov, ktoré sme doteraz riešili. V poslednom čase na úvodnú terapiu používame agresívny IV/SCI remdesivir a potom mačky prechádzajú na perorálny GS-441524 počas 10 týždňov trvajúcej konsolidačnej terapie.
Po počiatočnom používaní nižších dávok, ktoré neboli úspešné u každého pacienta, teraz používame nasledujúce liečebné protokoly:
- pre mačky s vlhkou FIP: 10-12 mg/kg raz denne (SID) počas 2 týždňov
- pre mačky s výrazným postihnutím oka: 15 mg/kg SID subkutánnou injekciou (SCI) počas 2 týždňov; mačkám s ťažkou uveitídou by sa mali podávať aj lokálne kortikosteroidy (Pred Forte alebo Maxidex) 2-3 dni (nie dlhšie!) a atropínová očná masť
- pre mačky s neurologickou FIP s príznakmi CNS: podávajte 20 mg/kg SID SCI počas 2-4 týždňov. 5
Je dôležité, aby majitelia boli riadne poučení o tom, ako optimálne podávať denné injekcie. Mačky budú vnímať injekciu ako menej bolestivú, ak sa roztok remdesiviru v injekčnej striekačke nechá zohriať na izbovú teplotu, namiesto toho, aby sa podával vychladený z chladničky. Okrem toho, ak ich naučíte jednoduchým úkonom, ako je používanie novej ihly pri aplikácii injekcii (t. j. použite inú ihlu, ako je tá, ktorá sa používa na natiahnutie lieku z vialky) a používanie ihiel priemeru 21G (0,8mm – zelené) alebo 23G (0,6mm – modré), injekcie budú znesiteľnejšie. Aj keď sú ihly 21G väčšie, u niektorých mačiek to možno dáva výhodu rýchlejšej aplikácie injekcie. Alternatívne môžu veterinári pripraviť kvôli zjednodušeniu pre majiteľa injekcie na celý týždeň, ktoré budú uchovávať v chladničke, a každý deň tak budú aplikovať novú injekciu.
U mačiek, ktoré naďalej vnímajú SC injekcie ako bolestivé, sme použili gabapentín perorálne (50 až 100 mg na mačku) a/alebo transmukozálne alebo SC podávaný buprenorfín 30-60 minút pred injekciou na sedáciu/analgéziu. Oblasť, do ktorej sa má podať injekcia, sa môže tiež ostrihať, aby sa 30 minút pred injekciou mohol aplikovať lokálny krém EMLA. BOVA vyrába rýchlejšie pôsobiaci lokálny anestetický gél, ktorý môže byť užitočný u niektorých pacientov. Vo výnimočných prípadoch sme zavádzali cefalický katéter každých 4-5 dní, aby majitelia mohli podávať IV terapiu namiesto SC injekcií. Zdá sa, že reakcie v mieste vpichu, ktoré boli hlásené v súvislosti s injekčne podávaným GS-441524 v zahraničí, sa pri remdesivire nevyskytujú.
Po 2-4 týždňoch užívania remdesiviru a po vymiznutí tekutiny v bruchu a zlepšení alebo vymiznutí očných a CNS príznakov teraz navrhujeme prechod na tablety GS-441524. Robí sa to z 3 dôvodov: (i) znižuje to náklady (ii) odstraňuje problém s bolestivosťou SC injekcií (iii) u niektorých pacientov je to efektívnejšie. Injekcie Remdesiviru sú pravdepodobne spoľahlivejšie ako perorálny GS-441524 a v najhorších prípadoch by ste sa mohli rozhodnúť podávať ich 4 týždne, ale pre väčšinu mačiek stačia 2 týždne a pohodlie a nižšie náklady na perorálnu formuláciu predbehnú všetko ostatné.
Používanie tabliet GS-441524 je v Austrálii pomerne nové, ale vo veľkej miere sa používa v zámorí. Odporúčaná perorálna dávka GS441524 je zvyčajne rovnaká ako dávka SCI/IV remdesiviru: vlhké prípady FIP dostanú 10-12 mg/kg PO SID, očné prípady 15 mg/kg PO SID a prípady CNS 20 mg/kg ( alebo vyššie). GS-441524 je ekonomickejší a je dokonca bezpečnejší ako remdesivir. V prípadoch CNS, kde sa podávajú veľké dávky, je pravdepodobne najlepšie podávať 10 mg/kg PO každých 12 hodín (BID), aby sa obišiel “stropný” efekt, o ktorom sa hovorí v súvislosti s obmedzenou absorpciou vysokých dávok.

Prečo sú dávkovania približne rovnaké? Na báze mg/kg má GS441524 dvakrát toľko aktívnych molekúl ako remdesivir (kvôli rozdielu v ich molekulovej hmotnosti), ale biologická dostupnosť GS-441524 je možno iba 50 % (absorbuje sa len polovica toho, čo sa podá, a to je ovplyvnené kŕmením a tiež efektom stropnej dávky) – takže tieto dva faktory sa navzájom rušia.
Odporúčame, aby sa tablety GS-441524 podávali s malým pamlskom, aby sa zamaskovala tabletka, pričom hlavné jedlo sa podáva o 1 hodinu neskôr. Tablety, ktoré poskytuje BOVA, sú 50 mg tablety s príchuťou tuniaka, so štyrmi deliacimi ryhami, takže ich možno rozdeliť na polovicu alebo dokonca na štvrtiny.
V situáciách, keď si majitelia nemôžu dovoliť úplnú liečbu, po prvotnej liečbe remdesivirom/GS-441524 používame meflochín (Lariam; 5 mg/kg perorálne raz denne v kapsulách alebo 62,5 mg dvakrát týždenne) .
Phillip McDonagh, Jacqui Norris, Merran Govendir a kolegovia zo Sydney School of Veterinary Science preukázali, že meflochín má antivírusový účinok . 7 K tomu pravdepodobne dochádza tým, že meflochín si uzurpuje biochemické intracelulárne dráhy využívané vírusom FIP, čo je mechanizmus, ktorý bol nedávno preukázaný aj pri klofazimíne 8 (lieku proti lepre), a niekoľkých ďalších liekoch. U niekoľkých mačiek, kde si majitelia nemohli dovoliť úplnú kúru remdesivirom, sa meflochín ukázal ako účinný pre dosiahnutie hranice klinického vyliečenia.
Hlavnou výhodou nákupu remdesiviru a GS-441524 od BOVA na liečbu prípadov FIP je, že produkty, ktoré používame, podliehajú kontrole kvality. Ide len o napísanie receptu s menom a adresou klienta, menom pacienta a dávkou, ktorá sa má podať, a kompaundátor môže zvyčajne poskytnúť vialky alebo tablety ktorémukoľvek veterinárnemu lekárovi v Austrálii do 24-48 hodín.
V súčasnosti je cena 100 mg vialky remdesiviru 250$ plus GST a poštovné (celková cena zvyčajne cca. 280$). GS-441524 sa predáva v balení 10 tabliet za 600$ plus poštovné a balné. Kúpou viacerých vialiek a tabliet súčasne sa samozrejme znížia poštovné a manipulačné poplatky. Veríme, že väčšina majiteľov sa bude cítiť oveľa pohodlnejšie, keď získa produkt od známej austrálskej spoločnosti, než aby posielali peniaze do zámoria a dúfali, že lieky neznámej kvality na čiernom trhu sa bezpečne dostanú do Austrálie bez toho, aby ich zadržala colnica.
Neexistuje žiadny dôvod, prečo by dobre motivovaný veterinár nemohol tieto prípady zvládnuť vo svojej vlastnej praxi. To je často pre majiteľa pohodlnejšie, najmä ak zápasia s každodennými injekciami a potrebujú praktika vo svojej blízkosti.

Veterinári, ktorí chcú preskúmať túto možnosť, alebo majú všeobecné otázky o manažmente prípadov FIP, môžu poslať e-mail Sally Coggins (dr.sallyc@gmail.com), Richardovi Malikovi (richard.malik@sydney.edu.au), Davidovi Hughesovi (concordvets@concordvets.com.au), Grette Howard (drgretta@gmail.com) alebo profesorke Jacqui Norris ( jacqui.norris@sydney.edu.au), o radu v súvislosti s diagnózou alebo liečbou. Mnoho austrálskych veterinárnych lekárov so záujmom o FIP dosiahlo značné odborné znalosti v manažmente týchto prípadov. Napríklad Andrew Spanner v Adelaide liečil viac ako 20 prípadov s vynikajúcimi výsledkami. Je teda už mnoho lekárov pre mačaciu medicínu a odborníkov na internú medicínu so skúsenosťami s liečbou FIP, a tak majú veterinári, ktorí váhajú s liečbou svojich vlastných prípadov, možnosť doporučiť svojim klientom týchto odborníkov.
Medzi lekárov, ktorí akceptujú prípady FIP od všeobecných lekárov, patria napríklad: QLD Rhett Marshall, Marcus Gunew, Alison Jukes, Rachel Korman; NSW Katherine Briscoe, Michael Linton, Randolph Baral, Melissa Catt; VIC – Carolyn O’Brien, Keshuan Chow, Amy Lingard; WA-Martine Van Boeijen a Univerzitná veterinárna nemocnica Murdoch; TAS Moira van Dorsselaer.
Všetci títo lekári (a pravdepodobne ešte viac, o ktorých nevieme) radi prijmú prípady na diagnostiku a terapiu. Všetci s vami pravdepodobne radi prediskutujú manažment prípadov.

Sally Coggins, spolupracujúca s Larou Boland, Emily Pritchard, docentkou Mary Thompsonovou a profesorkou Jacqui Norris na Sydney School of Veterinary Science, má záujem o liečbu prípadov s komplexnou diagnózou a monitorovaním poskytovaným zadarmo . Bude to tvoriť súčasť doktorandského programu Sally, takže jej budete pomáhať napredovať v štúdiu tým, že jej budete posielať prípady. Dúfame, že pomocou týchto študií, získame lepšiu predstavu o tom, ako rýchlo mačky reagujú, a kedy presne možno liečbu bezpečne ukončiť. Majitelia si budú musieť zaplatiť iba za remdesivir a GS-441524 na terapiu. Táto skupina má tiež záujem o liečbu prípadov interferónom-omega a meflochínom.
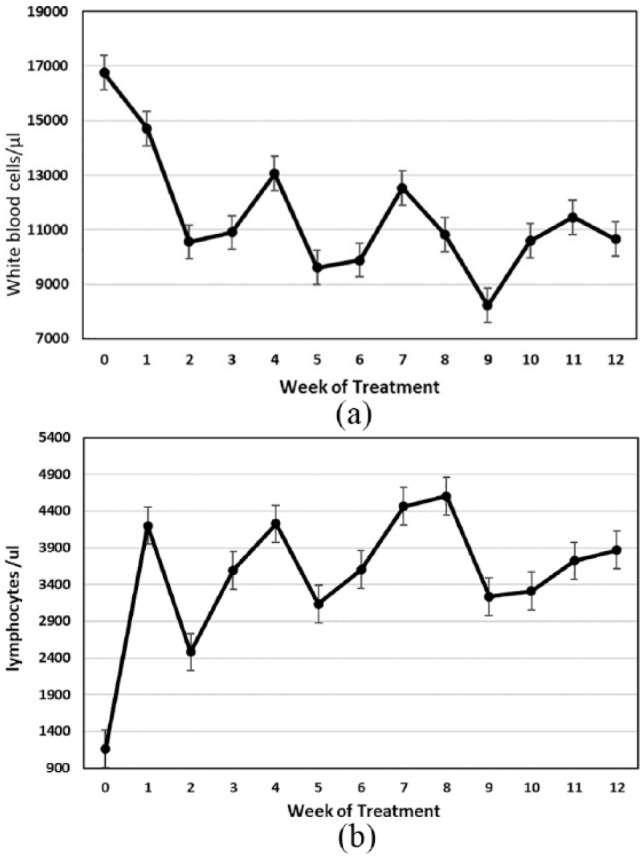
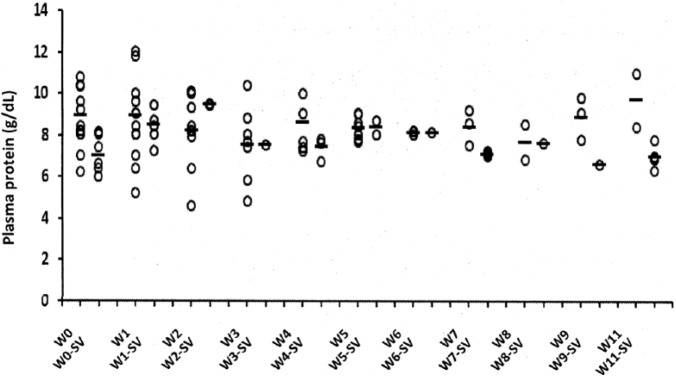
Väčšine prípadov FIP sa darí veľmi dobre pri liečbe GS-441524 alebo remdesivirom. Niels Pedersen zhromaždil úžasný zdroj pre veterinárnych lekárov, ktorí sa zaujímajú o manažment prípadov FIP – https://sockfip.org/dr – pedersen – research/ . Stránka uvádza aj niekoľko odporúčaní, ako sledovať mačky počas liečby. Nie som veľmi orientovaný na protokol, takže pre mňa sú kľúčové veci, ktoré treba sledovať, ako chuť do jedla, postoj, úroveň aktivity a zmeny telesnej hmotnosti a kondície v priebehu času. Väčšina lekárov rada monitoruje hematológiu a biochémiu séra každý mesiac, aby sa zabezpečilo, že všetky merateľné abnormality sa zlepšujú, hoci to môže byť pre pacienta stresujúce a zvyšuje to náklady na liečbu. Kompromisom je odobranie niekoľkých kvapiek krvi na sledovanie PCV, celkového proteínu v plazme (TPP) pomocou refraktometrie a farby plazmy – tak sa dá určiť, či sa anémia zlepšuje, ikterus ustupuje a či sa znižuje koncentrácia gamaglobulínu, čo má za následok nižšie TPP.
Neznepokojujte sa prechodným zvýšením koncentrácií globulínu na začiatku liečby; keď sa absorbujú výpotky s vysokým obsahom bielkovín, do plazmy pacienta sa dostane veľa imunoglobínov. Tento jav môže byť bežný až do 8. týždňa liečby, ale vymizne do 12. týždňa.

A čo mačiatko s multifokálnym ochorením CNS, kde je FIP CNS najpravdepodobnejšou príčinou klinických príznakov? Tradičným prístupom je sérológia (na vylúčenie kryptokokózy a toxoplazmózy), dobrá anamnéza a test tiamínu na vylúčenie nedostatku vitamínu B1, potom MRI skeny (obrázok 9) a odber CSF na analýzu tekutín a multiplexnú neuro-qPCR analýzu ). Tento prístup je veľmi drahý a existuje aj isté riziko z anestézie a najmä odberu CSF. Zistili sme, že 3-5 dňová intravenózna alebo sc. liečba remdesivirom sa môže použiť ako terapeutická skúška u mačiek s pravdepodobnou CNS FIP a je cenovo výhodnou alternatívou k úplnému diagnostickému spracovaniu, ktoré môže stáť 3-5000$ alebo viac .
Podobne, ak je voľbou exploračná laparotómia, biopsia abnormálnych tkanív, histológia a imunohistochémia pre FIP antigén na diagnostiku suchej intraabdominálnej FIP oproti 3–5-dňovej liečbe s remdesivirom alebo GS-441524, môže sa zvážiť test s použitím lieku, čo je lepšia voľba z hľadiska pohody pacienta a znížených nákladov. U väčšiny mačiek s neefuzívnou FIP nastáva rýchle zlepšenie pomocou antivírusovej terapie, s normalizáciou horúčky, zlepšením chuti do jedla a lepším celkovým postojom v priebehu 2 až 3 dní. Ak pacient nereaguje na antivírusovú terapiu, potom je samozrejme rozumná exploračná laparotómia a biopsia reprezentatívnych orgánov, keďže hlavnými diferenciálnymi diagnózami sú lymfóm a lymfocytická cholangitída.
Toto je vecou osobného prístupu každého lekára. FNA na cytologické a niekedy imunohistochemické vyšetrenie alebo PCR je presvedčivou neinvazívnou možnosťou tam, kde je táto expertíza dostupná, ale niekedy nedá definitívnu odpoveď. Niektorí veterinári trvajú na diagnostike tkaniva a pozitívnej imunohistológii alebo PCR u každého pacienta, zatiaľ čo iní by radi „liečili liečiteľné“ pomocou 3–5-dňového nasadenia remdesiviru/GS-441524 a pristúpili k exploratívnej laparotómii, až keď neexistuje jednoznačná odpoveď na terapiu.
Je neuveriteľne uspokojujúce vidieť premenu mačiek a mačiatok, ktorým nie je dobre, na normálne a šťastné mačky. Je to naozaj niečo, čo vám ako lekárovi zdvihne náladu. Je to dobrá veda a dobrá veterinárna medicína!
Závery
V minulosti bola diagnóza FIP intelektuálnym cvičením, aby sme utrpenie mačky alebo mačiatka mohli ukončiť s istotou presnej diagnózy. Teraz, vďaka celoživotnmu štúdiu FIP Dr. Nielsa Pedersena, sme schopní úspešne liečiť možno 80 % alebo viac mačiek s FIP, ak má klient dostatok financií. Je príliš skoro predpovedať, či alebo koľko z nich sa bude neskôr opakovať.
Existuje potreba intenzívneho štúdia v diagnostike a manažmente prípadov, ale s vynaložením potrebného úsilia by dobrý praktický veterinár mal byť schopný spolupracovať s odhodlaným majiteľom na dosiahnutí klinického vyliečenia. Najdôležitejšie je neklásť príliš veľa prekážok do cesty oddaného majiteľa a podporovať ho počas 12-týždňového maratónskeho liečebného kurzu tým, že mu pomôžete nájsť najlepší spôsob liečby svojho pacienta. Môže to zahŕňať sedatívnu/analgetickú liečbu, ktorá pomôže mačke zlepšiť ovládateľnosť a predchádzať nepríjemným pocitom, keď klient privedie svoju mačku na kliniku denne na injekcie remdesiviru alebo prechod na tablety GS-441524, keď je stres z injekcií pre vlastníka príliš veľký. Je dôležité zvládnuť dlhú cestu a možno poskytnúť platobný plán, ktorý umožní odhodlaným klientom zlepšiť cenovú dostupnosť liečby.
Napokon, vplyv COVID-19 na výskum koronavírusov bol skutočne hlboký a vo vývoji je niekoľko veľmi sľubných liekov, ako napríklad molnupiravir od spoločnosti Merck a ďalší perorálny liek od spoločnosti Pfizer.
CELKOVÉ ZHRNUTIE
2-stupňový prístup k terapii
1.fáza – INDUKCIA
IV/SC injekcie Remdesiviru
- Pre mačky s vlhkou FIP: 10-12 mg/kg remdesiviru subkutánnou injekciou (SCI) raz denne (SID) počas 2 týždňov
- Pre mačky s postihnutím oka: 15 mg/kg SID remdesivir SCI počas 2 týždňov
- Pre mačky s neurologickými príznakmi FIP a CNS: remdesivir 20 mg/kg SID počas 2 týždňov
2. fáza – KONSOLIDÁCIA
Po 2 týždňoch injekčného podávania remdesiviru prejdite na tablety GS-441524
- Pre mačky s vlhkou FIP: 10-12 mg/kg GS-441524 perorálne SID počas 10 týždňov
- Pre mačky s postihnutím oka: 15 mg/kg SID GS-441524 perorálne SID počas 10 týždňov
- Pre mačky s neurologickými príznakmi FIP a CNS: GS-441524 10 mg/kg perorálne BID (20 mg/kg/deň) počas 10 týždňov
Literatúra
- Kim, Y.; Liu, H.; Galasiti Kankanamalage, A.C.; Weerasekara, S.; Hua, D.H.; Groutas, W.C.; Chang, K.O.; Pedersen, N.C. Reversal of the progression of fatal coronavirus infection in cats by a broad-spectrum coronavirus protease inhibitor. PLoS Pathog. 2016, 12, e1005531.
- Pedersen, N.C.; Kim, Y.; Liu, H.; Galasiti Kankanamalage, A.C.; Eckstrand, C.; Groutas, W.C.; Bannasch, M.; Meadows, J.M.; Chang, K.O. Efficacy of a 3C-like protease inhibitor in treating various forms of acquired feline infectious peritonitis. J. Feline Med. Surg. 2018, 20, 378–392.
- Murphy, B.G.; Perron, M.; Murakami, E.; Bauer, K.; Park, Y.; Eckstrand, C.; Liepnieks, M.; Pedersen, N.C. The nucleoside analog GS-441524 strongly inhibits feline infectious peritonitis (FIP) virus in tissue culture and experimental cat infection studies. Vet. Microbiol. 2018, 219, 226–233.
- Pedersen, N.C.; Perron, M.; Bannasch, M.; Montgomery, E.; Murakami,
E.; Liepnieks, M.; Liu, H. Efficacy, and safety of the nucleoside analog GS441524 for treatment of cats with naturally occurring feline infectious peritonitis. J. Feline Med. Surg. 2019, 21, 271–281. - Dickinson PJ, Bannasch M, Thomasy SM, et al. Antiviral treatment using the adenosine nucleoside analogue GS-441524 in cats with clinically diagnosed neurological feline infectious peritonitis. Journal of Veterinary Internal Medicine. 2020. doi: 10.1111/jvim.15780.
- Tasker S. Diagnosis of feline infectious peritonitis: Update on evidence supporting available tests. Journal of Feline Medicine and Surgery.
2018;20(3):228-243. doi:10.1177/1098612X18758592 - McDonagh, P.; Sheehy, P.A.; Norris, J.M. Identification, and characterisation of small molecule inhibitors of feline coronavirus replication. Vet. Microbiol. 2014, 174, 438–447.
- Yuan, S., Yin, X., Meng, X. et al. Clofazimine broadly inhibits coronaviruses including SARS-CoV-2. Nature (2021).
https://doi.org/10.1038/s41586-021-03431-4 - https://sockfip.org/ – NAJLEPŠÍ zdroj na internete alebo kdekoľvek pre FIP.

NÁKLADY:
2 kg mačiatko s vlhkou FIP
4×100 mg vialky remdesiviru – 1000$
35×50 mg tabliet GS-441524 – 2100$
Manipulácia a GST – 30$ plus 310$ = 340$
Celkom 3440$, približne 290$ týždenne počas 12 týždňov
4 kg mačka so suchou FIP
7×100 mg vialiek remdesiviru – 1750$
70×50 mg tabliet GS-441524 – 4200$
Manipulácia a GST 30$ plus 600$
Celkom 6550$, asi 545$ týždenne počas 12 týždňov